免疫療法(免疫細胞治療)の治療効果・成績
ここでは、当院で免疫療法(免疫細胞治療)をお受けになった患者さんの治療効果・成績についてまとめています。当院では患者さん・ご家族にご納得の上で治療をお受けいただくため、長年の治療データを分析し、客観的なデータとして公開しています。
厚生労働大臣認定
認定再生医療等委員会設置医療法人/
国家戦略特別区域会議 構成員(東京圏)
ここでは、当院で免疫療法(免疫細胞治療)をお受けになった患者さんの治療効果・成績についてまとめています。当院では患者さん・ご家族にご納得の上で治療をお受けいただくため、長年の治療データを分析し、客観的なデータとして公開しています。
ここで紹介している治療効果のデータは、当院または連携医療機関で免疫細胞治療を1クール(6回)以上行った患者さん5,460名のうち、肺、胃、大腸、肝、膵、乳、子宮、卵巣の原発がん患者さんの1,198症例についてまとめたものです(調査期間は10年間)。
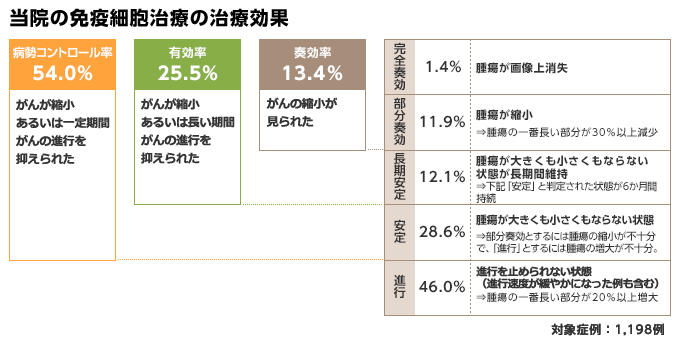
上記からは、およそ半数の患者さんで、がんが縮小、あるいは一定期間がんの進行を抑えられたことが読み取れます(※)。
なお、がんが画像上消失した場合は「完全奏効」、がんの直径が30%以上縮小した場合は「部分奏効」、がんが縮小しても30%に至らないものや大きさに変化がなかった場合は、その持続期間が6か月以上のものを「長期安定」、6か月未満を「安定」、そして進行を止められなかった場合を「進行」としています(この中には、治療により進行の早さが穏やかになった例も含まれます)。これらは「RECISTガイドライン」と呼ばれ、国際的に使用される治療効果判定のためのガイドラインをベースに作成したものです。
また、上記治療効果データの対象となった1,198名の患者さんの中には免疫細胞治療のみを受けている方と、化学療法など他の治療法を併用している方がいます。それぞれの結果について、以下の通りお示しします。
最近では、疾患毎の調査結果を論文で発表しています。
免疫細胞治療を6回実施し、治療前後で評価できた患者さんにおいて、以下のことを報告しています。
免疫細胞治療は、手術で取り残したり、術前の検査で発見できず再発の原因となってしまう微小ながんに対しても全身的に作用するため、再発予防には特に適しています。
手術後の再発予防治療として一般には化学療法が用いられますが、免疫機能の低下など副作用の問題が生じる場合もあります。免疫細胞治療は、副作用の心配をほとんどせずに、再発予防効果を期待できます。実際、千葉県がんセンターや国立がんセンター等の研究により、手術後に免疫細胞治療を行うことで再発が減少し、生存率が高まったという結果が、海外の権威ある学術誌に報告( Gastroenterology(2015)、Cancer Immunol Immunother(2014)、Lancet(2000)、Cancer(1997))されています。(※)
ここでは、数値化しやすく長年のデータ蓄積がある評価指標として「がんの縮小」を用いていますが、免疫細胞治療はがんの縮小のみを目指す治療ではありません。
免疫細胞治療は、がんを短期的に縮小させる効果では他の標準治療に劣りますが、完全治癒が望めない進行がんの方であっても、体力の低下をできるだけ抑えながら、高いQOL(生活の質)を保った生活を続けていただくことも可能な治療です。
本項の治療成績で示している「長期安定」は、そういった免疫細胞治療の治療効果を示すものと考え、「完全奏効」と「部分奏効」に加えて「長期安定」例も治療の有効例と判定しています。
長期安定と判定された方の中には、がんの大きさそのものにはほとんど変化が見られないにもかかわらず、何ら不都合なく生活している患者さんが大勢いらっしゃいます。
また、医学界においても、がんの縮小・消失だけを効果判定の基準とするのではなく、むしろQOL(生活の質)を重視し、できるだけ客観的にがんの治療効果をとらえようとする動きが出てきています。
当院でも免疫機能検査を導入し、免疫機能を数値化し治療前後で比較することで、免疫細胞治療の治療効果を客観的に判定しようとする動きを進めています。
